Infrastrutture
Nel 2019, grazie ad un finanziamento dedicato da parte del Ministro dell’Università e della Ricerca, l’Italia si è dotata per la prima volta di una nave da ricerca con capacità rompighiaccio per poter svolgere attività in aree polari. Alla nave è stato dato il nome Laura Bassi in onore della prima donna al mondo che, nel 18° secolo, ottenne una cattedra accademica all’Università di Bologna.
La nave, di proprietà dell’Istituto Nazionale di Oceanografia e di Geofisica Sperimentale (OGS) di Trieste, è finanziata per svolgere le attività previste dal Programma Nazionale di Ricerca in Antartide (PNRA) ma è a supporto di tutta la comunità scientifica grazie a un accordo tra i principali Enti nazionali che studiano le aree polari e ne gestiscono le infrastrutture (OGS, CNR ed ENEA). L’utilizzo della N/R Laura Bassi è anche inserito nel piano strategico del Programma di Ricerca in Artico (PRA).
La nave ha effettuato la sua prima spedizione nel mare di Ross nell’estate australe 2019-20. Attualmente si sta procedendo ad un profondo programma di potenziamento strumentale dell’infrastruttura, anche con il contributo di personale dell’ISP, per trasformarla in una moderna piattaforma scientifica multipurpose per coprire i diversi ambiti della ricerca marina, dall’oceanografia fisica, chimica e biologica alla paleoceanografia, dalla geofisica e geologia marina alla chimica e fisica dell’atmosfera.
Per maggiori informazioni visita il sito OGS

Breve descrizione
Le attività sperimentali svolte presso il BioChem Lab della sede di Roma si focalizzano sullo studio degli effetti di microinquinanti organici normati ed emergenti su organismi appartenenti a diversi livelli trofici (dalle comunità microbiche agli organismi superiori) nel contesto dei cambiamenti climatici in corso. Sono incluse in tali attività determinazioni analitiche sul biota per valutare il bioaccumulo/biomagnificazione dei contaminanti di interesse. Studi sulla loro degradazione (determinazione del tempo di emivita DT50 e analisi dei metaboliti o prodotti di trasformazione dell’analita di interesse) tramite allestimento di esperimenti in scala di laboratorio. Valutazione degli effetti di contaminanti selezionati sia su specifici organismi target (es. test di avoidance behaviour in Eisenia foetida) che sulla struttura (PhosphoLipid Fatty Acid analysis-PLFA) e funzionalità (Community Level Physiological Profile - CLPP) delle comunità microbiche autoctone, tramite allestimento di esperimenti in scala di laboratorio e monitoraggio ambientale. Studio sulla presenza e diffusione tra le comunità microbiche naturali dei geni che conferiscono resistenza agli antibiotici (ARGs) e del proxy dell’impatto antropico, gene intI1, da correlarsi alla presenza di antibiotici nella matrice ambientale di interesse.
Comparti ambientali di interesse
Gli studi di bioaccumulo/biomagnificazione dei microinquinanti organici riguardano prevalentemente pesci, molluschi, lombrichi terrestri e acquatici, specie vegetali terrestri e acquatiche. Gli studi sulla persistenza e gli effetti sulle comunità microbiche naturali includono diversi comparti ambientali quali: acque superficiali (marine, fluviali, lacustri), neve/ghiaccio, suoli, sedimenti.
Tecniche di studio
Gli studi di bioaccumulo/biomagnificazione e di persistenza dei contaminanti di interesse vengono eseguiti mediante la combinazione di procedure di:
- metodi di pretrattamento (es. liofilizzazione, dissezione, etc);
- metodologie estrattive e di purificazione (estrazione liquida pressurizzata-PLE, sonicazione, estrazione liquido-liquido-LL, estrazione in fase solida-SPE);
- metodologie analitiche sensibili e selettive basate sull’accoppiamento di tecniche cromatografiche (HPLC o GC) e rivelazione mediante fluorescenza, FID-ECD, spettrometria di massa.
- Il test di avoidance behaviour è basato sull’esposizione di organismi, nello specifico lombrichi appartenenti alla specie Eisenia foetida, a diverse concentrazioni sub-letali di contaminanti organici, al fine di valutare il loro comportamento di fuga/evitamento dalla zona contaminata.
- La valutazione della composizione microbica delle comunità naturali avviene tramite PLFA (PhosphoLipid Fatty Acid) profiling. Tale tecnica biochimica prevede una fase di estrazione degli acidi grassi dei fosfolipidi di membrana dalla matrice di interesse, una reazione di metilazione seguita da separazione e analisi mediante gas cromatografia.
- L’analisi della diversità microbica a livello funzionale avviene tramite analisi del profilo metabolico/fisiologico (CLPP). Questo saggio fisiologico prevede una fase di incubazione del campione ambientale in specifiche piastre e letture spettrofotometriche ad intervalli prestabiliti.
- L’analisi dei geni che conferiscono resistenza agli antibiotici e del proxy dell’impatto antropico, il gene intI1, avviene tramite estrazione del DNA dai campioni ambientali utilizzando specifici kit e successiva analisi tramite qPCR.
Strumentazione
 Il laboratorio è fornito della seguente strumentazione:
Il laboratorio è fornito della seguente strumentazione:
Liofilizzatore da banco (LABCONCO) con display touchscreen e capacità da 2,5 L, per la preparazione del campione da sottoporre ad estrazione liquida pressurizzata.
Solid Phase Extraction (SPE, Supelco): Estrattore in fase solida a 12 porte dove alloggiare cartucce contenenti fasi adsorbenti specifiche per l’estrazione di analiti di interesse da matrici liquide, con connessione ad un sistema da vuoto.
Syncore® Analyst (Buchi) per la pre-concentrazione in parallelo di campioni in fase liquida.
Rotavapor R 100 (Buchi), munito di interfaccia elettronica per il controllo del sistema da vuoto e del refrigeratore a ricircolo.
Gas Cromatografo (Perkin Elmer, Clarus 480) accoppiato con rivelatore FID-ECD (Flame Ionization Detector- Electron Capture Detector). Il Sistema è munito di un autocampionatore per l’esecuzione di analisi in sequenza (Autosystem, Perkin Elmer). Tale Sistema è interamente gestito mediante il TotalChrom Software.
Gas Cromatografo (Thermo Fisher, Trace 3000) accoppiato con spettrometro di massa (Thermo Fisher, ISQ7000). Il Sistema è munito di un autocampionatore per l’esecuzione di analisi in sequenza (Thermo Fisher. AI 1310). Tale Sistema è interamente gestito mediante il Chromeleon Software.
HPLC (sistema binario, Vanquish TM Core HPLC system, Thermo Scientific TM, Italia, Perkin Elmer, USA) accoppiato con rivelatore a spettrometria di massa ad altarisoluzione (Orbitrap Exploris 120, Thermo Scientific TM, Italia). Tale sistema è gestito mediante ilsoftware Xcalibur (versione 5.1).
Spettrofotometro (Biolog Microstation System, Biolog Inc.) lettore di micropiastre (96 pozzetti). Il sistema è controllato mediante uno specifico software.
Per informazioni: Dott.ssa Luisa Patrolecco – luisa.patrolecco AT cnr.it
Breve descrizione
Le attività sperimentali svolte presso il MicroChem Lab della sede di Roma si focalizzano sulla determinazione analitica di microinquinanti organici normati ed emergenti e dei loro metaboliti, finalizzate alla comprensione delle loro dinamiche di diffusione, distribuzione, persistenza e destino nei diversi comparti ambientali ed allo studio delle relazioni tra i cambiamenti climatici e la diffusione dei contaminanti a lungo e corto raggio. A tal fine, è necessaria la messa a punto e ottimizzazione di metodologie analitiche specifiche ed altamente sensibili che consentano la rilevazione di concentrazioni in traccia e sub-traccia degli analiti di interesse nelle diverse matrici.
Comparti ambientali di interesse
Le attività sono rivolte agli ecosistemi acquatici e terrestri, pertanto i comparti ambientali di interesse sono i seguenti: acque superficiali (marine, fluviali, lacustri), neve/ghiaccio, suoli, sedimenti, vegetazione acquatica e terrestre, biota.
Tecniche di studio
La determinazione dei microinquinanti organici di interesse viene eseguita mediante la combinazione di procedure di:
- metodi di pretrattamento (es. liofilizzazione, filtrazione, etc);
- metodologie estrattive e di purificazione (estrazione in fase solida-SPE, estrazione liquida pressurizzata-PLE, estrazione liquido-liquido-LL);
- metodologie analitiche sensibili e selettive basate sull’accoppiamento di tecniche cromatografiche (HPLC o GC) e rivelazione mediante fluorescenza, FID-ECD, spettrometria di massa.
Strumentazione
Il laboratorio è fornito della seguente strumentazione:
Liofilizzatore da banco (LABCONCO) con display touchscreen e capacità da 2,5 L, per il pretrattamento di matrici solide da sottoporre ad estrazione liquida pressurizzata.
Solid Phase Extraction (SPE): Estrattore in fase solida a 12 porte dove alloggiare cartucce contenenti fasi adsorbenti specifiche per l’estrazione degli analiti di interesse da matrici liquide con connessione ad un sistema da vuoto.
Sonicatore (Branson, mod. 2510) per l’estrazione, con gli opportuni solventi, degli analiti di interesse da determinate matrici solide.
ASE 150 (Dionex, Thermoscientific), per l’estrazione liquida pressurizzata (PLE) di contaminanti da matrici solide
Speed Extractor E-916 (Buchi), per l’estrazione liquida pressurizzata (PLE) di 6 campioni in parallelo, anche con differenti metodologie.
 Rotavapor R 100 (Buchi), munito di interfaccia elettronico per il controllo del sistema da vuoto e del refrigeratore a ricircolo.
Rotavapor R 100 (Buchi), munito di interfaccia elettronico per il controllo del sistema da vuoto e del refrigeratore a ricircolo.
Gas Cromatografo (Thermo Fisher, Trace 3000) accoppiato con rivelatore a spettrometria di massa(Thermo Fisher, ISQ7000). Il Sistema è munito di un autocampionatore per l’esecuzione di analisi in sequenza (Thermo Fisher. AI 1310). Tale Sistema è interamente gestito mediante il Chromeleon Software.
HPLC (sistema binario, Vanquish TM Core HPLC system, Thermo Scientific TM, Italia, Perkin Elmer, USA) accoppiato con rivelatore a spettrometria di massa ad altarisoluzione (Orbitrap Exploris 120, Thermo Scientific TM, Italia). Tale sistema è gestito mediante ilsoftware Xcalibur (versione 5.1).
Per informazioni: Dott.ssa Luisa Patrolecco – luisa.patrolecco AT cnr.it
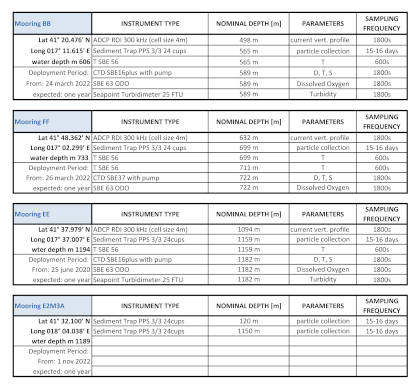
Ancoraggi strumentati Sud Adriatico - ULTIMO TITOLO Ancoraggio Strumentato Permanente Adriatico (ex) MSA AGGIORAMENTO 2023
Sistema osservativo del cascading di NAdDW in Adriatico Meridionale (Mooring Southern Adriatic, MSA)
MSA
L'Adriatico meridionale è la parte più profonda del Mare Adriatico con una profondità massima di 1200 m. Nella sua parte occidentale, le acque superficiali provenienti dall'Adriatico settentrionale scorrono verso sud lungo la costa italiana, mentre le acque ioniche scorrono verso nord lungo la costa croata. Sotto lo strato superficiale, l’acqua intermedia levantina modificata (MLIW), proveniente dal Mediterraneo orientale, entra nel mare Adriatico sul lato orientale dello Stretto di Otranto, ad una profondità compresa tra 200-600 m.
 L'Adriatico meridionale è un sito di formazione di acqua densa, l'Adriatic Deep Water (AdDW). Questa viene generata attraverso una convezione verticale profonda di oceano aperto, causata dalla perdita di calore superficiale a seguito di eventi di vento freddo che si verificano nel tardo inverno. Occasionalmente, contribuiscono all'AdDW anche le acque dense che si formano in piattaforma nel Nord Adriatico (NAdDW), durante l'inverno prodotte anche in questo caso dalla perdita di calore superficiale e dall'evaporazione causate dalle tempeste di Bora. La NAdDW costituisce l'acqua più densa di tutto il Mediterraneo orientale, scorre principalmente lungo la piattaforma occidentale del Mar Adriatico centrale come corrente di fondo seguendo il gradiente topografico e arriva al promontorio del Gargano dopo 2-4 mesi da quando è stata prodotta. Recentemente sono stati osservati tempi di arrivo più brevi (3-4 settimane). Una volta arrivata al ciglio della piattaforma continentale sprofonda verso il centro dell’Adriatico Meridionale lungo la scarpata di fronte al Gargano o attraverso il canyon di Bari, trasportando ossigeno disciolto, nutrienti, particellato, ed inquinanti agli ecosistemi bentonici profondi.
L'Adriatico meridionale è un sito di formazione di acqua densa, l'Adriatic Deep Water (AdDW). Questa viene generata attraverso una convezione verticale profonda di oceano aperto, causata dalla perdita di calore superficiale a seguito di eventi di vento freddo che si verificano nel tardo inverno. Occasionalmente, contribuiscono all'AdDW anche le acque dense che si formano in piattaforma nel Nord Adriatico (NAdDW), durante l'inverno prodotte anche in questo caso dalla perdita di calore superficiale e dall'evaporazione causate dalle tempeste di Bora. La NAdDW costituisce l'acqua più densa di tutto il Mediterraneo orientale, scorre principalmente lungo la piattaforma occidentale del Mar Adriatico centrale come corrente di fondo seguendo il gradiente topografico e arriva al promontorio del Gargano dopo 2-4 mesi da quando è stata prodotta. Recentemente sono stati osservati tempi di arrivo più brevi (3-4 settimane). Una volta arrivata al ciglio della piattaforma continentale sprofonda verso il centro dell’Adriatico Meridionale lungo la scarpata di fronte al Gargano o attraverso il canyon di Bari, trasportando ossigeno disciolto, nutrienti, particellato, ed inquinanti agli ecosistemi bentonici profondi.
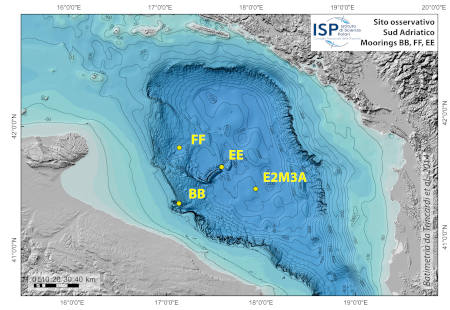
 Per monitorare l’arrivo stagionale dell’acqua densa proveniente dall’Adriatico settentrionale, e la sua variabilità interannuale e su lungo periodo per effetto dei cambiamenti climatici, è stato posizionato un sistema osservativo basato su tre catene correntometriche: i moorings BB, EE e FF. Questo sistema è stato attivato e finanziato a partire dal 2004 da diversi progetti scientifici (EU-EuroSTRATAFORM, EU-HERMIONE, PRIN-OBAMA, EU-Perseus, EU-CoCoNet, Progetto bandiera Ritmare (SP5-WP5-AZ3) e Strategia per l’ambiente marino (D. L. 190/2010). Inoltre questi ancoraggi oceanografici fanno parte della rete osservativa italiana di punti fissi (IFON) e, sono supportati dall’Ufficio Programmazione e Grant Office del CNR.
Per monitorare l’arrivo stagionale dell’acqua densa proveniente dall’Adriatico settentrionale, e la sua variabilità interannuale e su lungo periodo per effetto dei cambiamenti climatici, è stato posizionato un sistema osservativo basato su tre catene correntometriche: i moorings BB, EE e FF. Questo sistema è stato attivato e finanziato a partire dal 2004 da diversi progetti scientifici (EU-EuroSTRATAFORM, EU-HERMIONE, PRIN-OBAMA, EU-Perseus, EU-CoCoNet, Progetto bandiera Ritmare (SP5-WP5-AZ3) e Strategia per l’ambiente marino (D. L. 190/2010). Inoltre questi ancoraggi oceanografici fanno parte della rete osservativa italiana di punti fissi (IFON) e, sono supportati dall’Ufficio Programmazione e Grant Office del CNR.
Dal 2021 i siti BB e FF, sono entrati a far parte del consorzio EMSO-ERIC (European Multidisciplinary Seafloor and water column Observatory European-Research Infrastructure Consortium) come nodo osservativo del mare Adriatico meridionale composto dagli ancoraggi BB e FF e dal sito osservativo E2M3A gestito da OGS Trieste. EMSO-ERIC è un'infrastruttura europea di ricerca diffusa per l'osservazione degli oceani, che consente il monitoraggio a lungo termine e anche in tempo reale dei processi oceanici. Consiste di un sistema di Regional Facilities ubicate in siti marini strategici dei mari europei, nel Nord Est Atlantico, nel Mar Mediterraneo e nel Mar Nero. Ogni sito è equipaggiato con sensori multidisciplinari posizionati sul fondo marino e lungo la colonna d’acqua per misurare in continuo parametri fisici e bio-geochimici che consentono la comprensione e la descrizione di ecosistemi marini, il monitoraggio del cambiamento climatico e forniscono informazioni relativi a rischi naturali. La partecipazione al consorzio EMSO-ERIC include anche la misura dei flussi verticali di materiale particellato, tramite di n. 2 trappole di sedimento, nel mooring profondo dell’osservatorio E2-M3A (gestito da OGS Trieste) ubicato al centro della fossa Sud Adriatica.
La partecipazione ad EMSO-ERIC è sostenuta anche dalle attività della Joint Research Unit Italiana del consorzio (EMSO Italia). Infine il mooring BB è parte della Rete di Misurazioni in continuo a lungo termine della temperatura e salinità delle acque profonde del Mediterraneo (Programma Hydrochanges della CIESM).
L'ubicazione dei siti è stata scelta sulla base dell'integrazione di osservazioni morfo-batimetriche che definivano le aree in cui il passaggio delle acque dense era più probabile con previsioni basate sulla modellizzazione del deflusso delle acque dense. Il mooring BB è posizionato nel ramo settentrionale del canyon di Bari, il mooring EE è posizionato in un’area in erosione prospiciente il Dauno seamount, a circa 1200m di profondità, e il mooring FF è sulla scarpata continentale antistante il promontorio del Gargano (Schema mooring BB). I sensori oceanografici sono fissati a diverse altezze nella parte più profonda della colonna d'acqua. Le infrastrutture sono ubicate in mare aperto ed è possibile raggiungerle solo tramite un mezzo navale. Il porto di attracco principale più vicino è Bari. Il sito BB dista dal porto circa 20 mn, il sito FF circa 40 mn, il sito EE dista 45 mn ed il sito E2M3A circa 60 nm.
Gli strumenti impiegati sono dotati di memoria ed alimentazione interna. I dati oceanografici sono scaricati in modalità delayed durante la manutenzione degli ancoraggi che avviene con cadenza semestrale o annuale. Durante la manutenzione gli ancoraggi vengono recuperati per eseguire lo scarico dei dati, la raccolta dei campioni delle trappole, la sostituzione delle batterie e la verifica della funzionalità prima della rimessa a mare. Queste manutenzioni sono state eseguite utilizzando diverse navi da ricerca del CNR (R/V Urania, R/V Minerva Uno e N/O G. Dallaporta) o navi di opportunità nell’ambito delle attività sperimentali dei progetti sopracitati.
Personale coinvolto: Stefano Miserocchi (stefano.miserocchi AT cnr.it), Leonardo Langone e Patrizia Giordano.
 Breve descrizione
Breve descrizione
Nel laboratorio di Geochimica Organica dell'ISP di Bologna ricercatori e studenti si occupano di processi moderni e ricostruzioni paleo accoppiando l’informazione fornita dai biomarcatori fossili e dagli isotopi stabili del carbonio/azoto. I biomarcatori e gli isotopi stabili, collettivamente chiamati proxy, sono infatti strumenti di indagine per la comprensione dei feedback tra clima e cicli biogeochimici. Il laboratorio è dotato di diversi sistemi per estrarre, purificare e analizzare una serie di biomarcatori tra cui composti terrestri (e.g. fenoli della lignina, lipidi a catena alifatica, prodotti derivati dalla cutina) per comprendere lo scambio terra-oceano di carbonio (e.g. fusione del permafrost, piene fluviali, etc), alchenoni per indagini paleo sulla temperatura superficiale dell’oceano e isoprenoidi altamente ramificati per ricostruzioni paleo di ghiaccio marino. Inoltre, il laboratorio è dotato di un Preparative Fraction Collector (Agilent-Gerstel) per l'isolamento dei singoli composti. Questa tecnica, dedicata alle analisi al radiocarbonio dei biomarcatori, trova diversi impieghi come sviluppo di modelli di età per gli archivi climatici sedimentari e lo studio dei processi legati alla fusione del permafrost.
Strumentazione
Il laboratorio di Geochimica Organica è dotato di diversi sistemi gascromatografici per la quantificazione degli isotopi stabili del carbonio e azoto, per l’analisi elementale della sostanza organica (CHNS) e la quantificazione/isolamento di biomarcatori organici. La strumentazione disponibile include:
- Thermo Fisher Scientific FLASH 2000 Element Analyzer accoppiato ad uno spettrometro di massa DeltaQ (EA-IRMS)
- GC Agilent GC 7820-MSD EI 5977B
- GC Agilent 8860-FID G2790A
- GC Agilent 8890 integrato con un sistema di purificazione Gerstel PFC (Preparative Fraction Collector).
Per informazioni: Dott. Tommaso Tesi - tommaso.tesi AT cnr.it
 Breve descrizione
Breve descrizione
Le attività sperimentali svolte presso il BioSoundEcology Lab della sede di Messina si concentrano sull’analisi delle sorgenti acustiche sottomarine biologiche e lo studio delle dinamiche ecologiche degli animali marini vertebrati ed invertebrati che popolano gli habitat polari. Inoltre, le attività del laboratorio hanno un focus sulla valutazione degli impatti delle sorgenti acustiche di natura antropica sull’ecologia, la fisiologia ed il comportamento degli organismi marini. In particolare, attraverso lo studio dei suoni generati dagli animali, vengono approfonditi gli aspetti relativi alla loro biologia ed ecologia. L’analisi del rumore generato da attività umane, invece, fornisce gli elementi utili a comprendere gli effetti sugli animali attraverso lo studio delle risposte comportamentali e dello status fisiologico degli stessi.
Matrici di interesse
Le attività sono rivolte principalmente agli habitat marini.
Tecniche di studio
Vengono applicati metodi di acquisizione passiva dei dati acustici sia in field che in ambiente controllato e delle risposte animali al disturbo sonoro ambientale:
- Analisi dei dati acustici;
- Stima del rumore sottomarino e delle componenti acustiche ambientali;
- Valutazione delle dinamiche ecologiche attraverso l’analisi delle vocalizzazioni degli animali marini;
- Analisi delle variazioni biochimiche, fisiologiche e comportamentali degli animali esposti a disturbo acustico;
- Studio dell’ecologia acustica dei mammiferi marini.
Strumentazione
Il laboratorio è fornito di strumentazione per il monitoraggio acustico passivo (idrofoni cablati e sistemi autonomi di acquisizione dati acustici) e per lo studio in ambiente controllato degli effetti del rumore sugli organismi marini (videocamere, amplificatore, trasduttore acustico, software per l’analisi acustica e comportamentale).
Per informazioni: Dott. Francesco Filiciotto – francesco.filiciotto AT cnr.it
 Breve descrizione
Breve descrizione
Nel laboratorio HydroChem, presso la sede di Messina, si eseguono analisi chimiche per la caratterizzazione dei corpi idrici marini (costieri e pelagici) e lacustri, fornendo supporto tecnico-scientifico allo studio dei cicli biogeochimici e dei processi ecologici anche in relazione all’acidificazione marina, così come agli studi sulle biomasse microbiche condotte nel Laboratorio di Microscopia. In particolare, vengono eseguite analisi di ossigeno, salinità, pH, nutrienti (azoto e fosforo) e carbonio organico particellato. Nell’ambito dell’attività monitoraggio ambientale, diversi prototipi di analizzatori di nutrienti sono stati sperimentati sia su piattaforma fissa che su battello, in siti pristini o soggetti a inquinamento antropico.
Matrici di interesse
Le matrici analizzate sono in massima parte riconducibili all’idrosfera (acque marine e lacustri, brine).
Strumentazione
Il laboratorio è fornito di strumentazione di base per la chimica ambientale [spettrofotometro, spettrofluorimetro, luminometro, buretta digitale per titolazione ossigeno, centrifuga, salinometro, analizzatori automatici per nutrienti (ammoniaca, nitriti, nitrati e ortofosfati), cappe ad estrazione, pompe da vuoto, setti filtrazione, agitatore magnetico, pHmetro].
Per informazioni: Dott. Filippo Azzaro – filippo.azzaro AT cnr.it
 Breve descrizione
Breve descrizione
Le attività sperimentali svolte nel laboratorio EcoBiM, presso la sede di Messina, riguardano lo studio ecologico e biotecnologico dei microrganismi, in particolare procarioti, che popolano gli habitat polari marini e terrestri. Vengono approfonditi aspetti ecologici quali la diversità dei microrganismi, la loro risposta a condizioni di stress ambientale (derivanti da forzanti naturali o antropiche, quali cambiamento climatico e contaminazione chimica), le implicazioni astrobiologiche della vita in ambienti estremi, l’evoluzione e l’adattamento in ambienti polari. Il laboratorio svolge, inoltre, analisi rivolte alla valutazione delle capacità metaboliche e potenzialità biotecnologiche di microrganismi cold-adapted, ricercando biomolecole con applicazioni industriali e batteri in grado di rimuovere sostanze inquinanti a bassa temperatura in una visione di biorisanamento.
Matrici di interesse
Le matrici analizzate sono in massima parte riconducibili all’idrosfera (acque marine, fluviali e lacustri, brine) ed alla criosfera (permafrost, neve, ghiaccio marino e continentale, brine intrapermafrost), ma sono oggetto di studio anche i suoli ed i sedimenti. Particolare interesse riveste, inoltre, lo studio delle interazioni tra microorganismi e superfici biotiche (ad esempio, organismi pelagici e bentonici) ed abiotiche (come comunità microbiche colonizzanti materiali polimerici, indicate con il termine di plastisfera).
Tecniche di studio
Per la caratterizzazione microbiologica di ambienti estremi, analogamente alle procedure analitiche comunemente applicate per lo studio di aree temperate, si fa ricorso a metodi dipendenti (colturali) ed indipendenti (biomolecolari e biochimici) dalla coltivazione, tra cui:
- isolamento e mantenimento in coltura pura di ceppi batterici;
- tipizzazione fenotipica (caratteristiche fisiologiche, biochimiche e morfologiche) e genotipica (analisi delle sequenze di 16S rRNA e ricerca di geni funzionali) di batteri coltivabili;
- screening colturali per la ricerca di biomolecole utili (tra cui antibiotici, esopolisaccaridi, biosurfattanti);
- valutazione delle capacità metaboliche della comunità microbica attraverso saggi miniaturizzati;
- ibridazione in situ con sonde oligonucleotidiche (CARD-FISH) per caratterizzazione di comunità microbiche;
- estrazione di DNA e RNA ambientale per studi di metagenomica e metatrascrittomica;
- allestimento di microcosmi arricchiti con contaminanti organici ed inorganici e test di degradazione.
Strumentazione
Il laboratorio è fornito di strumentazione di base per la microbiologia ambientale ed applicata (cappa a flusso laminare, autoclave, incubatori e bagni termostatati, centrifughe, apparati di filtrazione, sonicatori, spettrofotometri, fluorimetri) e di attrezzature per la biologia molecolare (termociclatore e apparecchi per elettroforesi).
Per informazioni: Dott.ssa Angelina Lo Giudice - angelina.logiudice AT cnr.it
 Breve descrizione
Breve descrizione
Le attività sperimentali svolte presso il laboratorio MAMB della sede di Messina sono rivolte allo studio ecologico dei microorganismi applicando metodi specifici per la determinazione della abbondanza e biomassa dei procarioti (Batteri e Archea) e del fitoplancton, nonché per la descrizione morfometrica e morfologica a livello cellulare. La valutazione di tali caratteristiche fenotipiche fornisce un differente approccio all’analisi della struttura dell’ecosistema e permette di valutare l’eterogeneità delle popolazioni naturali. Variazioni di taglia, forma e morfologia cellulare sono considerati indicatori sensibili dei cambiamenti trofici e climatici negli ecosistemi. Il laboratorio svolge inoltre analisi per la quantificazione delle cellule vitali (Live/Dead) e respiranti (CTC+) utilizzando specifici biomarker microbici. Le attività del laboratorio vengono svolte anche a supporto dei Laboratori EcoBiM e BiogeM.
Matrici di interesse
Le matrici analizzate sono in massima parte riconducibili all’idrosfera (acque marine, fluviali e lacustri, brine), a suolo, sedimenti, al biofilm, alla criosfera (permafrost, neve, ghiaccio marino e continentale, brine intrapermafrost) e ad organismi acquatici.
Tecniche di studio
Tecniche microscopiche in epifluorescenza ed analisi d’immagine per la:
- determinazione della biomassa dei procarioti mediante conteggio e analisi morfometrica e morfologica delle cellule utilizzando filtri selettivi per il DAPI (4',6-diamidin-2-fenilindolo);
- determinazione delle cellule dotate di fluorescenza primaria utilizzando filtri selettivi specifici;
- quantificazione delle cellule dotate di attività respiratoria (5-Cyano-2,3-ditolyl-tetrazolium chloride- CTC), utilizzando filtri selettivi per la rodamina;
- quantificazione delle cellule vitali con membrane integre (Live/Dead) utilizzando filtri selettivi per la fluoresceina e rodamina;
- identificazione di cellule batteriche target mediante tecniche di immunofluorescenza (anticorpi fluoresceinati);
- stima dell’abbondanza relativa di gruppi filogenetici microbici mediante CARD-FISH (catalyzed reporter deposition-fluorescence in situ hybridization).
Strumentazione
- Microscopio ad epifluorescenza Zeiss AXIOPLAN 2 Imaging equipaggiato con videocamera digitale AXIOCAMHR (Zeiss) e software AXIOVISION 3.1. Caratteristiche tecniche. Lampada a vapori di mercurio ad alta pressione (100 W); obiettivo ad immersione 100XPlan-Neofluar; oculari da 10 X di cui uno dotato di reticolo quadrettato; set di filtri ottici interscambiabili e appropriati per:
DAPI: eccitazione G365, ripartitore cromatico FT395 e filtro di sbarramento LP420;
Fluorescenza primaria: BP450-490/FT510/LP515;
Rodamina: BP546/12; FT580; LP590;
Fluoresceina: BP450-490; FT510; LP520.
Per informazioni: Dott.ssa Giovanna Maimone – giovanna.maimone AT cnr.it - CNR-ISP Sede di Messina
 Breve descrizione
Breve descrizione
Le attività di ricerca condotte nel laboratorio BiogeM presso la sede di Messina sono finalizzate allo studio dei processi biologici marini e terrestri che modulano e influenzano le caratteristiche chimiche dell’ambiente polare e i relativi cicli di materia ed energia, anche in relazione ai cambiamenti climatici. Particolare attenzione è rivolta alla valutazione del ruolo dei microorganismi nel ciclo globale del carbonio e nei cicli biogeochimici dei nutrienti (azoto, fosforo) di ambienti marini e lacustri, attraverso lo studio dei processi sia produttivi che degradativi. Tra questi, le attività coinvolte nella decomposizione dei polimeri organici, tramite attività enzimatiche microbiche, ed i processi di mineralizzazione attraverso la respirazione microbica. I processi biogeochimici mediati dalla componente microbica sono oggetto di studio anche nell’ambito della criosfera per comprendere il significato ecologico dei microbi nel permafrost, e la loro capacità di mantenere un metabolismo attivo in condizioni di vita estreme. Insieme ai processi microbici legati alla pompa biologica ed alla decomposizione della materia organica, vengono determinati anche una serie di parametri biogeochimici indiretti connessi alla biomassa fitoplanctonica e batterica (Clorofilla, ATP, lipopolisaccaridi-LPS).
Matrici di interesse
Le matrici analizzate sono in massima parte riconducibili all’idrosfera (acque marine, fluviali e lacustri, brine), a suolo, sedimenti, al biofilm, alla criosfera (permafrost, neve, ghiaccio marino e continentale, brine intrapermafrost) e ad organismi acquatici.
Tecniche di studio
Presso il laboratorio BiogeM vengono effettuate misure per la determinazione dei seguenti parametri:
- Produzione primaria fitoplanctonica;
- Attività respiratoria microbica (O2 consumato; CO2 prodotta) (tramite saggio ETS);
- Attività enzimatiche microbiche (leucin aminopeptidasi, beta-glucosidasi e fosfatasi alcalina) (mediante substrati fluorogenici);
- Produzione batterica eterotrofica;
- Contenuto in Clorofilla-a totale e frazionata (pico-, nano- e micro-fitoplanctonica), feopigmenti;
- ATP microbico nelle frazioni pico-, nano e microplanctoniche;
- Analisi quantitativa dei lipopolisaccaridi (LPS) mediante il test cromogenico LAL.
Strumentazione
Spettrofluorimetro, Luminometro, fluorimetro, spettrofotometro corredato di lettore di fluorescenza su piastre a 96 pozzetti, incubatore, autoclave, bilancia, omogenizzatore, sistemi di filtrazione, centrifuga refrigerata.
Per informazioni: Dott.ssa Gabriella Caruso – gabriella.caruso AT cnr.it - CNR-ISP Sede di Messina
More...

Breve descrizione
Tra gli inquinanti emergenti, le microplastiche sono diffuse in tutto il globo. In relazione alle loro dimensioni, queste particelle possono essere scambiate come particelle di cibo, possono essere ingerite e accumulate negli organismi, entrando così nella rete trofica. Considerata la loro persistenza ed abbondanza in tutti i comparti ambientali, le microplastiche costituiscono un rischio per l’ambiente e anche la salute umana. Possono inoltre essere vettori di altri inquinanti (inquinanti organici ed elementi in tracce), favorendone l’accumulo all’interno degli organismi. La definizione delle microplastiche è stata data dalla European Chemical Agency nel 2019 (ECHA, 2019): particelle contenenti polimeri solidi alle quali possono essere aggiunti additivi o altre sostanze, e dove più dell’1% w/w delle particelle presentano le dimensioni comprese tra 1nm ≤ x ≤ 5mm o per fibre di lunghezza compresa tra 3nm ≤ x ≤ 15mm, con rapporto lunghezza/diametro >3. Polimeri naturali che non hanno subito modificazioni chimiche (come l’idrolisi) sono esclusi da questa definizione (ECHA 2019). Le microplastiche possono essere primarie e secondarie; fonti di microplastiche primarie sono gli scarichi delle lavatrici, l’usura degli pneumatici, l’urban dust, cosmetici e prodotti per la cura della persona. Una analisi quantitativa accurata con una chiara identificazione del polimero sono necessarie per valutare correttamente l’impatto ambientale di questa classe di inquinanti e per poi progettare azioni correttive per la gestione ambientale.
Strumentazione
Micro-FTIR Nicolet™ iN™10 Infrared Microscope Thermo Scientific, microscopio ottico accoppiato ad uno spettroscopio IR; dotato di due detector: il primo che lavora a temperatura ambiente ((detector DTG (Deuterato Triglicina solfato)), il secondo raffreddato ad azoto liquido (Mercury Cadmium Telluride (MCT) detto anche cooled detector). Ha tre modalità di analisi: trasmissione, riflessione, ATR ed è dotato di videocamera digitale.
Matrice e tipo di misura
Analisi non distruttiva di campioni discreti di acqua marina, sedimenti, suolo, permafrost, acqua dolce, organismi (crostacei, bivalvi, pesci, ecc.), particolato atmosferico, neve, scarichi da lavatrici. Analisi di polimeri plastici, additivi plastici, composti inorganici, fibre naturali. Con il microFTIR è possibile quantificare le particelle/fibre microplastiche, gli additivi, ecc. presenti e simultaneamente identificare il polimero. Questo strumento viene impiegato nell’analisi delle microplastiche, ma è anche utilizzato per le discipline relative al restauro. Si possono analizzare microplastiche presenti in diverse matrici ambientali: dagli scarichi provenienti dalle lavatrici alle acque marine, dal permafrost ai fluidi biologici, ecc.
Per informazioni: Dr. Fabiana Corami - fabiana.corami AT cnr.it - CNR-ISP Sede di Venezia

Cromatografo liquido ad elevate prestazioni Agilent 1100 series HPLC system
Breve descrizione
La strumentazione HPLC-MS/MS permette di determinare quantitativamente composti organici polari in diverse matrici ambientali e vegetali e in campioni di biota. Viene comunemente usato per lo studio di traccianti specifici di sorgenti o processi ambientali in campioni prelevati nelle aree polari. Viene usato per la determinazione del levoglucosano, tracciante principale della combustione di biomassa, nelle carote di ghiaccio per lo studio del profilo storico del regime dei fuochi in studi paleoclimatici. Diversi composti organici idrosolubili (amminoacidi liberi e combinati, composti fenolici) sono determinati usando il sistema HPLC-MS/MS in campioni di aerosol per definire la composizione chimica atmosferica in campioni urbani o polari. Pesticidi polari o tossine sono comunemente determinati con questo sistema in campioni di acque dolci, acqua di mare, biota o campioni vegetali.
Strumentazione
Cromatografo liquido ad elevate prestazioni Agilent 1100 series HPLC system (Waldbronn, Germany) dotato di degasatore, sistema di pompe binario, autocampionatore e comparto termostato per le colonne accoppiato con uno spettrometro di massa triplo quadrupolo "API 4000 " (Applied Biosystems/MDS SCIEX, Toronto, Ontario, Canada) dotato di sorgente Turbo V.
Per informazioni: Dr. Roberta Zangrando - roberta.zangrando AT cnr.it - CNR-ISP Sede di Venezia
Matrice e tipo di misura
Analisi di campioni discreti di ghiaccio, neve, aerosol atmosferico, acqua lacustre, acque dolci, acqua di mare, sedimento, matrici vegetali. Analisi di composti organici polari quali ad esempio anidrozuccheri, amminoacidi, composti fenolici, acidi organici.
Agilent 1100 series HPLC system accoppiato a API 4000, cromatografo liquido ad elevate prestazioni accoppiato con uno spettrometro di massa triplo quadrupolo. (IMMAGINE)

Cromatografo liquido UHPLC mod. Dionex Ultimate 3000 Dual Pump RS
Breve descrizione
Questo strumento è l'elemento chiave per realizzare l'analisi in semicontinuo dei composti organici in campioni di ghiaccio.
Strumentazione
Cromatografo liquido UHPLC mod. Dionex Ultimate 3000 Dual Pump RS (Thermo ScientificTM) con degasatore e termostato per le colonne.
Per informazioni: Dr. Elena Barbaro - elena.barbaro AT cnr.it - CNR-ISP Sede di Venezia
Matrice e tipo di misura
Analisi in semicontinuo di carote di ghiaccio. Sistema da accoppiare alla continuous flow analysis (CFA).
Dionex Ultimate 3000 Dual Pump RS Thermo Scientific, cromatografo Liquido UHPLC doppia pompa. (IMMAGINE)

Mercur Plus - Analytik Jena AG, spettrofotometro di fluorescenza atomica a vapori freddi (CV-AFS).
Breve descrizione
La spettroscopia di fluorescenza atomica a vapori freddi (CV-AFS) è una tecnica analitica utilizzata per la determinazione del mercurio a livelli di tracce/ultra-tracce. Viene utilizzata principalmente su matrici acquose "pulite" (ad es. ghiaccio, neve e acqua) da aree remote e incontaminate.
La sensibilità dello strumento viene sfruttata utilizzando metodi ufficiali come US-EPA 1631 versione E o UNI-EN 15853: 2010. Il Hg presente nella matrice viene ossidato a Hg2+ con una soluzione di BrCl e quindi ridotto a mercurio elementare (Hg0) con SnCl2. Il Hg0 viene strippato dalla matrice acquosa usando un gas di trasporto inerte (argon) e successivamente trasportato in trappole d'oro per la pre-concentrazione mediante formazione di amalgama. Dopo il desorbimento termico a T tra 450-500° C, il Hg0 viene desorbito dalle trappole d'oro e viene trasportato in una cella di quarzo.
La luce proveniente da una lampada a vapori di mercurio attraversa la cella di quarzo, che contiene il mercurio in un flusso di gas carrier (argon), eccita tutti gli atomi di mercurio che emettono una caratteristica radiazione di fluorescenza a 253,7 nm. La quantità di luce emessa dagli atomi di mercurio nel campione è proporzionale alla quantità di mercurio che passa attraverso la cella di quarzo. La CV-AFS del CNR-ISP è collocata all’interno di una clean room dedicata.
Strumentazione
Mercur Plus - Analytik Jena AG, spettrofotometro di fluorescenza atomica a vapori freddi (CV-AFS).
Per informazioni: Dr. Massimiliano Vardè - massimiliano.varde AT cnr.it - CNR-ISP Sede di Venezia
Matrice e tipo di misura
Matrici acquose: deposizioni atmosferiche, neve, ghiaccio, acque potabili, acque minerali, acque superficiali, acque di mare. Mercurio, come mercurio totale, o dopo trattamento del campione come disciolto, filtrato e non filtrato.
Mercur Plus - Analytik Jena AG, spettrofotometro di fluorescenza atomica a vapori freddi (CV-AFS). (IMMAGINE)

Gas cromatografo interfacciato con Spettrometro di massa (GC-MS)
Breve descrizione
Il sistema GC-MS permette la quantificazione di composti volatili apolari in matrici ambientali. In campo ambientale trova la sua principale applicazione nella determinazione di inquinanti organici persistenti (POPs) quali PCBs, PBDEs, PAHs, pesticidi, in matrici ambientali sia in aree urbane che remote come le aree polari. Come pure trova applicazione nella determinazione composti per la cura dell’igiene personale come le fragranze che sono state osservate non solo in area urbana ma anche in Antartide.
Nei laboratori della sede di Venezia sono presenti 3 sistemi GC-MS. Fra questi il sistema dotato di trappola criogenica permette la preconcentrazione di composti volatili (permettendo la quantificazione di composti volatili difficili da analizzare in GC anche in quantità bassissima).
È presente inoltre un sistema dotato di pirolizzatore che permette l’analisi di materiali non volatili come materiali plastici.
Strumentazione
• GC-MS 7890A-5975C (Agilent)
• GC-MS GC7890A+MS5975C (Agilent)con trappola criogenica MARKES Int
• GC-MS GC6890+MS5973 (Agilent)con pirolizzatore Pyroprobe 5000 Series
Per informazioni: Dr. Elena Argiriadis - elena.argiriadis AT cnr.it - CNR-ISP Sede di Venezia
Matrice e tipo di misura
Analisi di campioni discreti di ghiaccio, neve, aerosol atmosferico, acqua lacustre, acque dolci, acqua di mare, sedimento, matrici vegetali. Analisi di composti apolari volatili quali PCBs, PBDEs, PAHs, pesticidi, fragranze, sterols.
GC-MS 7890A-5975C Agilent (IMMAGINE)
Breve descrizione
Nel laboratorio SpeM, presso la sede di Venezia, i ricercatori si occupano della caratterizzazione chimica (elementi in traccia) ed isotopica (δD, δ13C, δ15N, δ18O) di matrici naturali e della determinazione del contenuto totale di carbonio e azoto (in suoli e sedimenti).
Per elementi in traccia si intendono tutti quegli elementi della tavola periodica presenti nelle matrici naturali con concentrazioni inferiori a 1 ppm (parti per milione). La quantificazione di tali elementi consente, oltre alla caratterizzazione chimica dei campioni esaminati, di valutare eventuali problemi di contaminazione, anche derivanti da attività umane, di comprendere gli scambi che possono avvenire tra i vari comparti dei diversi ecosistemi, di studiare l’origine e la provenienza degli elementi e di ricostruire variazioni temporali legate a cambiamenti climatici attuali e del passato.
Per isotopi si intendono atomi appartenenti ad uno stesso elemento chimico quindi con lo stesso numero atomico ma che differiscono per il numero di massa (differiscono cioè tra loro per il numero di neutroni contenuti all'interno del nucleo). Gli isotopi sono dunque uguali da un punto di vista chimico ma differenti da un punto di vista fisico. Si differenziano in stabili e instabili o radioattivi. Tra gli isotopi stabili più studiati troviamo l’ossigeno, il carbonio, l’idrogeno e l’azoto. Lo studio degli isotopi stabili valuta l’abbondanza relativa tra i vari isotopi di un elemento e dà una misura del rapporto tra uno degli isotopi pesanti e quello più leggero (il più abbondante in natura) di un determinato elemento. Tale rapporto in natura non è costante ma può variare in conseguenza di processi chimici, fisici e biologici che possono portare ad un impoverimento o ad un arricchimento di un isotopo rispetto all’altro nelle varie fasi di un sistema naturale: si parla di frazionamento isotopico. Gli isotopi stabili hanno applicazioni fondamentali per gli studi ambientali e paleoambientali. Ad esempio, la misura di δ18O in una carota di neve/ghiaccio consente di effettuare una ricostruzione dell’andamento della temperatura nel passato.
Strumentazione



Element XR DeltaV Advantage Elemental Analyzer Flash2000HT
ICP-SFMS Element XR Thermo Scientific equipaggiato con vari sistemi di introduzione del campione (spray-chamber Scott-type in PFA; spray-chamber ciclonica, in vetro o in PFA, raffreddata con sistema Peltier; sistema APEX-ESI dotato di spray-chamber ciclonica riscaldata e di un sistema di raffreddamento per la riduzione delle interferenze da ossidi e doppie cariche sia in vetro che in PFA, resistente all’acido fluoridrico; sistema ARIDUS-CETAC dotato di spray-chamber in PFA riscaldata e di membrana riscaldata, per l’abbattimento di ossidi e doppie cariche). Lo strumento è inoltre dotato di autocampionatore protetto da una cappa a flusso laminare che mantiene pulita l’area dove si trovano i campioni durante le sessioni di analisi.
Per informazioni: Dr. Giulio Cozzi - giulio.cozzi AT cnr.it - CNR-ISP Sede di Venezia
IRMS DeltaV Advantage Thermo Scientific con: GasBench (con autocampionatore), Analizzatore Elementale (Elemental Analyzer Flash HT con doppia fornace, due autocampionatori per solidi e un autocampionatore per liquidi e ConFloIV) e Gascromatografo (GC Trace con autocampionatore).
Per informazioni: Dr. Clara Turetta - clara.turetta AT cnr.it - CNR-ISP Sede di Venezia
EA Elemental Analyzer Flash2000HT Thermo Scientific con doppia fornace, due autocampionatori per solidi e un autocampionatore per liquidi.
Per informazioni: Dr. Clara Turetta - clara.turetta AT cnr.it - CNR-ISP Sede di Venezia
Matrice e tipo di misura
ICP-SFMS: neve/ghiaccio, acqua di mare, acque superficiali e sotterranee, acque interstiziali. Determinazione di elementi in traccia e subtraccia (da ppb a ppq).
IRMS - Gas-Bench: Acque (neve/ghiaccio, acqua di mare, acque superficiali e sotterranee, acque interstiziali), carbonati (foraminiferi, carbonati s.s.). Determinazione di δD, δ13C, δ18O.
IRMS - EA: suoli, sedimenti, biota. Determinazione di δ13C, δ15N.
EA: suoli, sedimenti, biota. Determinazione di azoto totale (TN), carbonio totale (TC) e di carbonio organico (OC).
La rete BSRN (Baseline Surface Radiation Network) è nata per migliorare la qualità delle misure dei flussi radiativi Terra-Atmosfera che determinano le condizioni termiche e la circolazione dell'atmosfera e dell'oceano. L’ISP ha in carico la gestione dell’osservatorio installato presso la stazione Italo-Francese Concordia in Antartide. Installata nel 2006 la BSRN e finanziata con continuità dal PNRA, è costituita da una serie di strumenti passivi (radiometri e fotometri) per la misura delle diverse componenti del bilancio radiativo (sia nello spettro solare che in quello infrarosso), compreso l’albedo superficiale.
Oltre a queste misure, durante l’estate australe vengono anche misurati il contenuto colonnare di aerosol tramite un fotometro solare SP02 e lo spettro della radiazione ultravioletta tramite un radiometro UV-RAD), da cui è possibile ricavare il valore di ozono, anch’esso su tutta la colonna atmosferica.
Altre misure che vengono effettuate nell’ambito delle attività dell’osservatorio in collaborazione con l'Istituto Meteorologico Finlandese (FMI) riguardano le proprietà fisiche e ottiche del particolato atmosferico al suolo: coefficienti di diffusione ed assorbimento e la distribuzione dimensionale.
 Ministero dell'Universita e Ricerca
Ministero dell'Universita e Ricerca
Programma Ricerche Artico
Programma Nazionale di Ricerca in Antartide
 Ministero degli Affari Esteri e della Cooperazione Internazionale
Ministero degli Affari Esteri e della Cooperazione Internazionale
L'Italia e l’Artico
L’Italia e l’Antartide
CNR-ISP
Consiglio Nazionale delle Ricerche
Istituto di Scienze Polari
c/o Campus Scientifico - Università Ca' Foscari Venezia - Via Torino, 155 - 30172 VENEZIA MESTRE (VE)
Salvo diversa indicazione, il contenuto di questo sito è concesso in licenza : Attribuzione - Non commerciale - Condividi allo stesso modo 4.0 Internazionale (CC BY-NC-SA 4.0) 
Privacy policy e Cookie policy - Amministrazione trasparente CNR